DAFTAR ISI
7.7 Hubungan Molar dengan Pereaksi Gas [ Kembali]
Satu mol gas apa saja yang diukur
pada STP adalah 22,4 L. hubungan ini merupakan dasar untuk menghitung volume
pereaksi-pereaksi gas dan hasil reaksi gas yang terlibat dalam reaksi kimia.
Jika suatu volume diberikan pada sesuatu tekanan dan temperature, selain dari
STP, maka dilakukan koreksi dengan menggunakan hukum-hukum gas.
Perhitungan stoikiometri dalam mana
zat-zat gas terlibat, dapat dikelompokkan sebagai hubungan bobot-volume atau
hubungan volume-volume.
7.7.1
Hubungan Bobot-Volume
Contoh :
1.
Hitunglah
volume dalam liter pada STP dari hidrogen dan oksigen kering, yang secara
teoretis diperoleh dari penguraian 100 g air secara elektrolisis.
Jawaban : untuk memecahkan problem ini,pertama-tama ditulis persamaan
kimia berimbang dan hitung banyaknya mol hidrogen dan oksigen yang terbentuk
dari penguraian 100 g air. Dengan mengalirkan jumlah molar 22,4 L/mol,
diperoleh volume.
2. Jika 500 kg air diuraikan, berapakah
volume hydrogen dan oksigen kering, yang diperoleh jika masing-masing gas
ditampung pada 25,0 atm dan 26° C?
Jawaban
: Dari jawaban contoh 1 diketahui bahwa
5.56 mol H2 diperoleh dari 100 g air, Maka dari 500 kg air akan
diperoleh :
Pada
25,0 atm, tekanan dalam satuan SI adalah (25,0 atm)(1,013 X 105 Pa/atm) = 2,53 X 106 Pa.
7.7.2
Hubungan Volume-volume, Dalam 1805 dan segera setelah itu, J.L. Gay-Lussac
melakukan sederetan eksperimen yang menyimpulkan suatu hukum yang sekarang
disebut hukum volume-volume bereaksi
(dari) Gay Lussac, Gas-gas bereaksi
satu sama lain dalam volume-volume yang berangkabanding bilangan bulat kecil,
jika volume-volume itu diukur pada tekanan dan temperatur yang sama. hukum
Gay-Lussac ini menyajikan sebagian yang melatar belakang yang memungkinkan
Avogadro,dalam tahun 1811, melontarkan hitotesis bahwa gas yang volumenya sama,
mengandung molekul yang sama banyak.
Karena
hanya volume hidrogen yang diberikan, maka tak dapat dihitung jumlah mol
(kecuali bila diandaikan suatu kondisi, misalnya STP). Tetapi dapatlah
dimanfaatkan fakta bahwa,pada temperatur dan tekanan yang sama,volume gas
berbanding lurus dengan jumlah mol atau banyaknya molekul. Karena volume yang
sama mengandung sama banyak molekul (bukan Avogadro).
7.8
Hukum Dalton Mengenai Tekanan Parsial [ Kembali]
Dalam suatu campuran gas yang
berlainan tiap gas melakukan sebagian dari tekanan. Tekanan ini sama dengan
tekanan yang akan dilakukan oleh gas itu, seandainya gas itu menghuni sendirian
volume campuran gas itu. Hubungan ini dirumuskan oleh Dalton kira-kira dalam
tahun 1803 dan dikenal sebagai hukum
Dalton. Tekanan total dalam suatu
campuran gas adalah jumlah tekanan parsial anggota-anggota campuran. Secara
matematis,
Ptotal = p1 + p2
+ p3 + …
Huruf p
kecil menunjuk ke tekanan parsial, yakni tekanan yang dilakukan oleh
masing-masing gas dalam campuran itu
Contoh
:
Suatu
contoh hidrogen dikumpulkan dalam sebuah botol di atas air. Dengan
hati-hati,tinggi permukaan air di dalam botol diatur agar sama dengan di luar
botol. Pengukuran berikut dilakukan : volume gas 425 cm3;tekanan
udara luar 753 mmHg;temperatur air (dan juga gas) 34°C. Hitunglah volume hidrogen seandainya hidrogen ini kering dan
bertekanan 760 mmHg dan temperatur 0°C.
Analisis, hydrogen tercampur dengan uap air. Oleh
karena itu tidak seluruh 753 mmHg merupakan tekanan yang dilakukan oleh hydrogen; sebagian kecil tekanan itu
disebabkan oleh uap air. Tekanan uap air berubah menurut temperatur. Tekanan
yang disebabkan oleh hydrogen dapatlah sekarang dihitung dengan bantuan hukum
Dalton :
Ptotal = pH2O +
pH2 atau pH2
= Ptotal - pH2O
= 753 mmHg – 40mmHg = 713 mmHg
Tekanan terakhir ini merupakan
tekanan yang dilakukan oleh hidrogen sendiri, yakni tekanan yang dianggap tekanan
asli untuk menghitung volume hydrogen kering pada 0°C dan 760 mmHg.
Karena
n konstan,dapatlah digunakan
persamaan
jawaban
7.9
Hukum Defusi (Efusi) Graham [ Kembali]
Suatu gas dengan rapatan tinggi akan
berdifusi lebih lambat daripada gas yang berapatan rendah, Ditekan dalam tahun
1830 oleh Thomas Graham dan pernyataan tepatnya disebut hukum graham, Laju
difusi dua gas berbandding terbalik dengan akar (kuadrat)rapatan mereka Secara
matematis,
Dengan
r1 dan r2 adalah laju difusi dua gas dan d1 dan d2 rapatan masing-masing.
Contoh 7.16.
Pada
kondisi standar 1L gas oksigen berbobot hampir 1,44g,sedangkan 1L hidrogen
berbobot hanya 0,09g Gas mana berdifusi lebih cepat? Hitunglah berapa kali
lebih cepat.
Analisis
Menurut
hukum Graham,Hidrogen akan berdifusi lebih cepat karena rapatanya lebih
rendah.Faktornya adalah
Jawaban.
Persamaan
itu ditata secara logis, Telah diketahui bahwa rH2 lebih besar daripada rO2
maka pengganda untk rO2 pastilah lebih besar daripada satu.
Difusi adalah suatau penyamaan
keadaan-keadaan fisika secara sertamerta(spontan).Difusi menyangkut zat-zat
yang berbeda, difusi merujk ke percamuran partikel ketika mereka bergerak untk
menjadi terdisdtribusi secara seragam satu diantara yang lain.Efusi ialah
gerakan partikel-partikel gas lewat suatu lubang sempit.
Menurut hukum Avogrado ,rapatan gas berbanding lurus dengan bobot molekunya, Oleh karena itu bobot molekul dapat menggantikan rapatan dalam rumus hukum difusi (efusi)Graham.
Menurut hukum Avogrado ,rapatan gas berbanding lurus dengan bobot molekunya, Oleh karena itu bobot molekul dapat menggantikan rapatan dalam rumus hukum difusi (efusi)Graham.
Bobot
molekul suatu gas dapat ditentukan dengan mengukur laju efusinya dan
membandingkan laju ini dengan laju untuk gas yang bobot molekulnya telah
diketahui.
7.10
Simpangan dari Hukum-hukum Gas [ Kembali]
Hukum-Hukum gas hanya eksak bila
diterapkan pada gas yang disebut gas ideal.Molekl-molekul gas semacam ini tidak
saling menarik ; Molekul-molekul itupun tidak memerlukan ruang dalam wadah itu
(suatu situasi yang tidak mungkin).
Namun gas nyata tidak bertindak ideal sepenuhnya;
Artinya, molekul-molekul nerkea saling tarik menarik dan memerlukan ruang.Suatu gas tertentu makin kurang ideal bila tekanan ditigkatkan dan/atau temperatur diturunkan.
1. Jika tekanan dibesarkan, molekul suatu gas
dipaksa lebih berdekatan dan juga proporsi volume yang ditempati
molekul-molekul itu sendiri menjadi lebih besar (volume total mengecilo)
2. Jika temperatur diturunkan, energi kinetik
molekul-molekul itu berkurang, sehingga gaya tarik-menarik menjadi lebih
efektif.
Besarnya simpangan dari perilaku gas ideal
bergantung juga pada macam gas, Gas seperti hidrogen,helium,nitrogen dan
oksigen, yang molekulnya tidak teral tarik menarik satu sama alain, bertindak
lebih ideal pada tekanan temperatur biasa ,dibandingkan dengan gas klor dan
amonia,molekulnya saling menarik. Vol
Artinya,
molekul-molekul nerkea saling tarik menarik dan memerlukan ruang.Suatu gas
tertentu makin kurang ideal bila tekanan ditigkatkan dan/atau temperatur
diturunkan.
1. Jika tekanan dibesarkan, molekul suatu gas
dipaksa lebih berdekatan dan juga proporsi volume yang ditempati
molekul-molekul itu sendiri menjadi lebih besar (volume total mengecil)
2. Jika temperatur diturunkan, energi kinetik
molekul-molekul itu berkurang, sehingga gaya tarik-menarik menjadi lebih
efektif.
Besarnya simpangan dari perilaku gas ideal
bergantung juga pada macam gas, Gas seperti hidrogen,helium,nitrogen dan
oksigen, yang molekulnya tidak teral tarik menarik satu sama alain, bertindak
lebih ideal pada tekanan temperatur biasa ,dibandingkan dengan gas klor dan
amonia,molekulnya saling menarik. Volume nyata per mol daripada lima belas gas
dicantumkan dalam tabel 7.2.selisih antara harga-harga ini dan 22,414 L
merupakan satu ukuran perilaku tak ideal.
Tabel 7.2 Volume molar dan tetapan gas,R dari
beberapa gas
R
= PV/nRT
Gas
|
Rumus
|
Volume molar
|
||
Ideal
|
22,414
|
0,082057
|
8,31244
|
|
Hidrogen
|
H2
|
22,428
|
0,082109
|
8,3197
|
Helium
|
He
|
22,426
|
0,082101
|
8,3189
|
Neon
|
Ne
|
22,425
|
0,082098
|
8,3186
|
Nitrogen
|
N2
|
22,402
|
0,082021
|
8,3108
|
Karbon monoksida
|
CO
|
22,403
|
0,082017
|
8,3104
|
Oksige
|
O2
|
22,392
|
0,081984
|
8,3071
|
Argon
|
Ar
|
22,393
|
0,081982
|
8,3068
|
Nitrogen oksida
|
NO
|
22,389
|
0,081966
|
8,3052
|
Metana
|
CH4
|
22,360
|
0,081860
|
8,2945
|
Karbon dioksida
|
CO2
|
22.,256
|
0,081845
|
8,2930
|
Hidrogen klorida
|
HCL
|
22,249
|
0,081424
|
8,2503
|
Asetilena
|
C2H2
|
22,19
|
0,08124
|
8,232
|
Amonia
|
NH3
|
22,094
|
0,08087
|
8,8194
|
Klor
|
Cl2
|
22,063
|
0,08076
|
8,183
|
Etilena
|
C2H4
|
22,241
|
0,081424
|
8,2503
|
7.11 Teori Molekul Kinetik [ Kembali]
Penemuan awal mengenai
gas tidaklah mudah untuk diterangkan
seperti yang kita harapkan. Torricelli dan Boyle bekerja dalam abad
tujuh belas, sedangkan Dalton pada abad
delapan belas. Terdapat keterangan mengenai kerja barometer yang didasarkan
pada kekuatan yang terbatas dari funiculus
(Latin : tali kecil) yang tak nampak, yang melekatkan diri antara puncak
tabung barometer dan permukaan merkurium. Adakah materi bersifat sinambung
ataukah berpartikel-partikel, artinya apakah terus-menerus dapat dibelah
ataukah terdiri dari atom-atom dan kehampaan ?
7.11.1 Keadaan Gas; Fakta dan
Teori.
Berikut ini beberapa eksperimen
yang dibuat seabad yang lalu, disandingkan dengan gugusan yang didukung oleh
masing-masing.
Fakta : Contoh gas dengan bobot beberapa
saja akan mengisi wadah yang tertutup. Jika wadah itu berpori, gas akan bocor
keluar lewat lubang-lubang yang tak terlihat di bawah miksroskop.
Teori : Gas terbuat dari
partikel-partikel subpartikel yang disebut molekul, yang selalu bergerak cepat
dan acak. Sebuah molekul bergerak lurus sampai bertabrakan dengan molekul lain
atau dinding wadah. Karena kecil, molekul-molekul dapat bergerak melewati
pori-pori halus dan meninggalkan wadah.
Fakta : Volume kuantitas tertentu gas
dapat di kurangi dengan memampatkannya.
Teori : Molekul-molekul gas dapat dipaksa
berdekatan satu sama lain dengan menambah tekanan.
Fakta : Suatu benda yang bergerak seperti
misalnya suatu bola golf atau palu, mempunyai sejumlah tertentu energy kinetik,
yang bergantung pada dua besaran masa benda: massa benda itu dan kecepatannya.
Dalam persamaan
.
.
Teori : Fakta bahwa rumus
berlaku untuk semua benda bergerak merupakan alasan untuk yakin bahwa rumus itu juga berlaku untuk molekul-molekul gas yang bergerak.
berlaku untuk semua benda bergerak merupakan alasan untuk yakin bahwa rumus itu juga berlaku untuk molekul-molekul gas yang bergerak.
Fakta : Dalam suatu wadah tertutup gas melakukan tekanan tertentu.
Selama volume tetap sama dan tak ada kalor yang dilepaskan atau diterima,
tekanan akan tetap sampai kapanpun.
Teori : Tabrakan antara molekul bersifat elastis (lenting)
sempurna; artinya tak ada perubahan netto energy kinetik. Jika energy terbuang,
temperature dan tekanan akan berkurang.
7.11.2 Suatu Model Molekul untuk Perilaku Gas
Teori molekul kinetik gas
adalah sebagai berikut :
1.
Gas
terdiri dari molekul yang berjarak jauh satu dari yang lain dalam ruangan yang
tanpa molekul-molekul ini akan hampa.
2.
Molekul
bergerak kian kemari dengan kecepatan tinggi, dengan lintasan lurus tetapi
arahnya acak.
3.
Molekul-molekul
saling bertabrakan, tetapi tabrakan ini bersifat elastic sempurna.
4.
Kecepatan
rata-rata molekul bertambah jika temperature naik dan berkurang jika
temperature turun.
5.
Pada
temperature tertentu, molekul gas A dan B mempunyai energi kinetik rata-rata
yang sama. Membesarnya massa m, diambil dengan menurunnya kecepatan rata-rata, v.
Artinya, pada suatu temperature tertentu,
. Jika mA lebih besar daripada mA, maka vA harus lebih kecil daripada vA.
. Jika mA lebih besar daripada mA, maka vA harus lebih kecil daripada vA.
Sejak gagasan dasar ini mulai dikembangkan,
teori molekul dikembangkan dengan makin terperinci. Sekarang diketahui bahwa
gerakan kasar dari titik ke titik, gerakan
translasi, hanyalah salah satu gerakan yang mungkin dimiliki oleh
molekul-molekul. Molekul mempunyai gerakan
rotasi, dan atom-atom dalam satu molekul terus-menerus mengubah posisi
relatifnya berkat gerakan vibrasi. Ketiga
gerakan untuk satu molekul diatom.















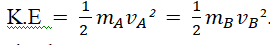


Tidak ada komentar:
Posting Komentar